خانه » فناوری نوین در درمان سرطان » ایمونوتراپی در درمان سرطان
ایمونوتراپی در درمان سرطان
فهرست مطالب (کلیک کنید)
سیستم ایمنی یک شبکه پیچیده از سلولها، اندامها، بافتها و پروتئینهاست که از بدن در برابر ابتلا به عفونتهای مختلف محافظت می کند. این سیستم می تواند سلولهای خودی بدن را از سلولها یا عوامل بیگانه تشخیص دهد و همین ویژگی سبب حمله به عوامل مهاجم خارجی و از بین بردن آنها میگردد.
نظارت بر ایمنی سرطان فرآیند مهمی است که توسط آن سیستم ایمنی، سلولهای توموری جدید را شناسایی می کند و از بین می برد. به طور معمول، سیستم ایمنی سلول های توموری را بر اساس آنتی ژن های مرتبط با تومور (TAAs) شناسایی می کند. انواع مختلفی از سلولهای ایمنی و مسیرهای مولکولی وجود دارد که منجر به حذف سلولهای سرطانی میشود. سلولهای T سایتوتوکسیک و سلولهای کشنده طبیعی NK-Cell زیرگروهی از گلبولهای سفید هستند که نقش کلیدی در مبارزه با سرطان برعهده دارند. سیستم ایمنی ابتدا سلول های سرطانی را شناسایی و نشانه گذاری می کند. پس از تشخیص سلول های سرطانی، نوعی از سلول های T به نام سلول های T کمک کننده ( T helper cell) با آزادسازی ترکیبات شیمیایی به نام سایتوکاین، سبب سیگنال دهی به سایر سلول های سیستم ایمنی شده و آن ها را به منطقه تومور جذب می کنند. درنهایت، سلول های T تنظیمی (Treg) با سرکوب کردن سیستم ایمنی، از فعالیت بیش از اندازه آن جلوگیری کرده و بدن را از حضور عوامل بیگانه پاکسازی می کنند. با این حال، سلول های توموری از طریق مکانیسم های مختلفی از سیستم ایمنی فرار کنند.
چهار مکانیسم اصلی فرار ایمنی وجود دارد:
1) کاهش ایمنی زایی با کاهش بیان آنتی ژن سطحی.
2) تنظیم کردن نقاط بازرسی ایمنی روی سطح سلول سرطانی برای سرکوب فعالیت سلول های ایمنی.
3) به کارگیری سلول های ایمنی سرکوبگر مانند سلول های سرکوبگر مشتق از میلوئید (MDSCs) و سلول های T تنظیمی (Treg) و همچنین سیتوکین ها برای تشکیل یک ریزمحیط سرکوب گر سیستم ایمنی.
4) آزادسازی متابولیت های اسیدی و سمی که فعالیت سلول های ایمنی را در ریزمحیط تومور مهار می کنند.
بسیاری از سرطان ها می توانند از سیستم ایمنی بدن فرار کرده و یا آن را تضعیف کنند، بنابراین بدن، آنها را به عنوان یک تهدید تشخیص نمی دهد
تاریخچه ایمونوتراپی
اولین پیشرفت علمی مدرن در ایمونوتراپی به دو پزشک آلمانی به نام های Busch و Fehleisen در اواخر دهه 1800 نسبت داده می شود. این پزشکان متوجه شدند که روند بهبودی بیماران مبتلا به سرطان پس از آلوده شدن به انواع خاصی از باکتریها، افزایش می یابد و پس از این تجربه، این دو محقق به این نتیجه رسیدند که تزریق این باکتریها به افراد مبتلا به سرطان منجر به کاهش اندازه تومور می شود. دکتر ویلیام بی کولی، که اکنون به عنوان پدر ایمونوتراپی شناخته می شود، برای اولین بار در اواخر قرن نوزدهم تلاش کرد تا از سیستم ایمنی برای درمان سرطان استفاده کند. او کوکتل باکتریایی شامل (استرپتوکوک و Serratia marcescens) معروف به سموم کولی را برای درمان بیماران مبتلا به سرطان، به ویژه کودکان مبتلا به سارکوم تولید کرد. امروزه می دانیم که اثر این سموم در از بین بردن سرطان بواسطه خانواده سیتوکینها شامل اینترلوکینها، اینترفرونها و کموکاینها است.
موج انقلابی بعدی در ایمونوتراپی سرطان با درک بهتر فرآیند نظارت بر سیستم ایمنی به وجود آمد که به وسیله آن سلولهای ایمنی ذاتی، سلولهای سرطانی را حذف میکنند. کشف اخیر Immune Checkpoint Inhibitors، مانند CTLA-4 و PD-1، زمینه ایمونوتراپی را به عصر کنونی سوق داد.
نقش ایمونوتراپی در درمان سرطان
سرطان دومین عامل مرگ و میر انسان پس از بیماری های قلبی و عروقی بوده و تعداد بیماران همچنان در حال افزایش است. درمان سرطان شامل برداشتن ناحیه توموری با استفاده از جراحی، پرتودرمانی، شیمی درمانی و درمان دارویی هدفمند می باشد و در سال های اخیر ایمونوتراپی چشم اندازهای امیدوارکننده ای را در درمان سرطان ایجاد کرده است. در ایمونوتراپی، برخلاف درمانهای سنتی مانند شیمیدرمانی و پرتودرمانی که مستقیماً بیماری را هدف قرار میدهند، پاسخ ایمنی بدن برای شناسایی و حمله به سلولهای غیرطبیعی تحریک یا تقویت می شود.
درمانهای مبتنی بر ایمونوتراپی در انواع سرطان (سرطانهای خون مانند لنفوم، لوسمی، مولتیپل میلوما و همچنین سرطان مثانه، پوست، کلیه و…) بسیار موفق بوده است. برخی از این درمانها ممکن است برای پیشرفتهترین و سختترین سرطانها (مانند سرطان ریه یا سرطان لوزالمعده در مراحل پیشرفته و برخی از انواع سرطان روده بزرگ) مؤثر باشند و میزان اثربخشی آن به پارامترهای مختلفی مانند سیستم ایمنی فرد، نوع و مرحله سرطان و همچنین شرایط درمان وابسته است. این روش درمانی در برخی موارد برای اثر بخشی بیشتر ممکن است در ترکیب با درمان های دیگر مانند جراحی، شیمی درمانی یا پرتودرمانی استفاده شود.
انواع روش های ایمونوتراپی در درمان سرطان
انواع مختلفی از ایمونوتراپی وجود دارد که هر کدام رویکرد و مکانیسم اثر خاص خود را دارند و عبارتند از:
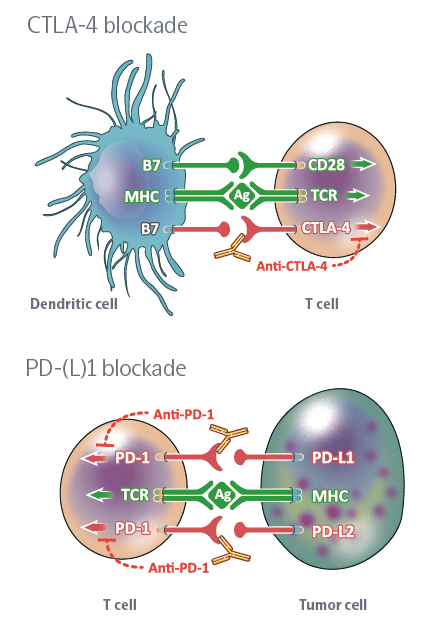
- Immune Checkpoint Inhibitors
- T-Cell Therapy
- Cancer Vaccines
- Cytokine Therapy
مهارکننده های چک پوینت ایمنی
(Immune Checkpoint Inhibitors)
ایمنی سرطان یک فرآیند پویا است که رابطه بین سلول های تومور و سیستم ایمنی را توصیف می کند و توسط پست های بازرسی ایمنی (Immune Checkpoint) تنظیم می شود و شامل نظارت بر ایمنی و پیشرفت تومور است.
فرآیند بازرسی ایمنی از سه مرحله تشکیل می شود:
- حذف تومور
- تعادل بین تومور و سیستم ایمنی
- سرکوب سیستم ایمنی.
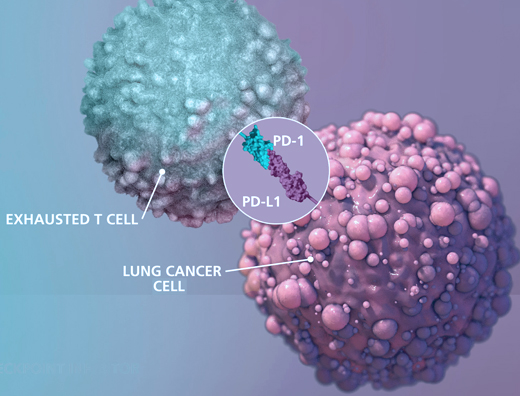
Immune Checkpoints، پروتئینهایی هستند که به عنوان “سوئیچ خاموش” سیستم ایمنی عمل می کند و منجر به جلوگیری از حمله سلول های T به سایر سلول های بدن می شود. به طور معمول، نقاط بازرسی خاصی وجود دارد که از حمله سیستم ایمنی به سلول های سالم جلوگیری می کند. سلول های سرطانی گاهی اوقات می توانند از این نقاط بازرسی برای فرار از سیستم ایمنی استفاده کنند، هنگامی که Immune Checkpoint و پروتئین های سطح سلول سرطانی به یکدیگر متصل می شوند، سیگنال “خاموش” را به سلول های T ارسال می کنند که منجر به جلوگیری از تخریب سرطان توسط سیستم ایمنی می شود. به عنوان مثال پروتئین PD-1 یک پروتئین نقطه بازرسی بر روی سلول های T است که پس از اتصال به گیرنده خود بر سطح سلول های دیگر منجر به سرکوب سیستم ایمنی در محل می شود، این گیرنده به میزان زیاد بر سطح سلول های سرطانی بیان می شود و همین امر منجر به سرکوب سیستم ایمنی در موضع تومور می گردد.
Immune Checkpoint Inhibitors نوعی ایمونوتراپی است که از اتصال پروتئین های Immune Checkpoint به پروتئین های سطح سلول سرطانی جلوگیری می کند و به سیستم ایمنی اجازه میدهند تا سلولهای سرطانی را به طور مؤثرتری شناسایی کرده و به آنها حمله کند.
از این روش درمانی برای سرطان هایی مانند سرطان پوست، ملانوما و همچنین به عنوان درمانی برای NSCLC سرطان ریه استفاده می شود. از داروهای این دسته می توان به
Ipilimumab (Yervoy), Nivolumab, Pembrolizumab (Keytruda), atezolizumab (Tecentriq), Durvalumab (Imfinzi) Avelumab (Bavencio)
اشاره کرد.
ایمنی سرطان یک فرآیند پویا است که رابطه بین سلول های تومور و سیستم ایمنی را توصیف می کند و توسط پست های بازرسی ایمنی (Immune Checkpoint) تنظیم می شود و شامل نظارت بر ایمنی و پیشرفت تومور است.
فرآیند بازرسی ایمنی از سه مرحله تشکیل می شود:
- حذف تومور
- تعادل بین تومور و سیستم ایمنی
- سرکوب سیستم ایمنی.
Immune Checkpoints، پروتئینهایی هستند که به عنوان “سوئیچ خاموش” سیستم ایمنی عمل می کند و منجر به جلوگیری از حمله سلول های T به سایر سلول های بدن می شود. به طور معمول، نقاط بازرسی خاصی وجود دارد که از حمله سیستم ایمنی به سلول های سالم جلوگیری می کند. سلول های سرطانی گاهی اوقات می توانند از این نقاط بازرسی برای فرار از سیستم ایمنی استفاده کنند، هنگامی که Immune Checkpoint و پروتئین های سطح سلول سرطانی به یکدیگر متصل می شوند، سیگنال “خاموش” را به سلول های T ارسال می کنند که منجر به جلوگیری از تخریب سرطان توسط سیستم ایمنی می شود. به عنوان مثال پروتئین PD-1 یک پروتئین نقطه بازرسی بر روی سلول های T است که پس از اتصال به گیرنده خود بر سطح سلول های دیگر منجر به سرکوب سیستم ایمنی در محل می شود، این گیرنده به میزان زیاد بر سطح سلول های سرطانی بیان می شود و همین امر منجر به سرکوب سیستم ایمنی در موضع تومور می گردد.
Immune Checkpoint Inhibitors نوعی ایمونوتراپی است که از اتصال پروتئین های Immune Checkpoint به پروتئین های سطح سلول سرطانی جلوگیری می کند و به سیستم ایمنی اجازه میدهند تا سلولهای سرطانی را به طور مؤثرتری شناسایی کرده و به آنها حمله کند.
از این روش درمانی برای سرطان هایی مانند سرطان پوست، ملانوما و همچنین به عنوان درمانی برای NSCLC سرطان ریه استفاده می شود. از داروهای این دسته می توان به Ipilimumab (Yervoy), Nivolumab, Pembrolizumab (Keytruda), atezolizumab (Tecentriq), Durvalumab (Imfinzi) Avelumab (Bavencio) اشاره کرد.

برخی از شایعترین عوارض جانبی Immune checkpoint inhibitors
استفاده از این دسته داروها، اغلب با عوارض جانبی مرتبط با سیستم ایمنی، مانند فعال شدن سیستم ایمنی و پاسخ التهابی علیه بافت های سالم میزبان همراه است.
برخی از عوارض رایج این درمان شامل اسهال، خستگی، سرفه، حالت تهوع، بثورات پوستی، کاهش اشتها، یبوست، درد عضلات و مفاصل است.
سایر عوارض جانبی جدی تری که به ندرت رخ می دهد شامل :
واکنش های انفوزیون: برخی از افراد ممکن است در حین مصرف این داروها واکنش انفوزیون داشته باشند که شامل واکنشی آلرژیک است و می تواند شامل تب، لرز، برافروختگی صورت، بثورات پوستی، خارش پوست، احساس سرگیجه، خس خس سینه و مشکل در تنفس باشد.
واکنش های خودایمنی: این داروها عملا عملکرد تنظیمی سیستم ایمنی بدن را از بین می برند و منجر به حمله سیستم ایمنی به بافت های سالم می شوند به همین دلیل خطر ابتلا به بیماری های خود ایمنی مانند دیابت نوع -1 را افزایش می دهند.
T-cell Therapy
T-Cell Therapy یک رویکرد نوآورانه و امیدوارکننده در زمینه درمان سرطان است که شامل استفاده از سلول های T خود بیمار یا سلول های T مهندسی شده برای هدف قرار دادن و از بین بردن سلول های سرطانی است. در این روش، از لنفوسیت های T بیمار برای مبارزه با سرطان استفاده می شود. به این صورت که سلولهای T از خون بیمار جدا میشوند و در آزمایشگاه به نحوی اصلاح میشوند تا گیرندههای خاصی تولید کنند که به آنها اجازه میدهد سلولهای سرطانی را شناسایی کرده و به آنها حمله کنند.
انواع مختلفی از درمان با سلول های T وجود دارد، دو روش شناخته شده آن عبارتند از:
- درمان با سلول های گیرنده آنتی ژن کایمریک CAR T-Cell Therapy
- درمان با لنفوسیت های نفوذ کننده تومور
Tumor-Infiltrating lymphocyte Therapy
T-Cell Therapy یک رویکرد نوآورانه و امیدوارکننده در زمینه درمان سرطان است که شامل استفاده از سلول های T خود بیمار یا سلول های T مهندسی شده برای هدف قرار دادن و از بین بردن سلول های سرطانی است. در این روش، از لنفوسیت های T بیمار برای مبارزه با سرطان استفاده می شود. به این صورت که سلولهای T از خون بیمار جدا میشوند و در آزمایشگاه به نحوی اصلاح میشوند تا گیرندههای خاصی تولید کنند که به آنها اجازه میدهد سلولهای سرطانی را شناسایی کرده و به آنها حمله کنند.
انواع مختلفی از درمان با سلول های T وجود دارد، دو روش شناخته شده آن عبارتند از:
- درمان با سلول های گیرنده آنتی ژن کایمریک CAR T-Cell Therapy
- درمان با لنفوسیت های نفوذ کننده تومور
Tumor-Infiltrating lymphocyte Therapy
درمان با سلول های گیرنده آنتی ژن کایمریک CAR T-Cell Therapy
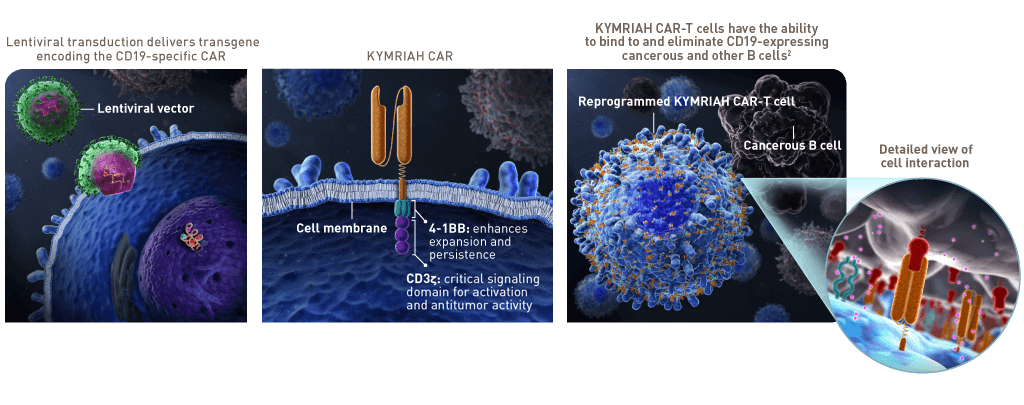
درمان با سلول های گیرنده آنتی ژن کایمریک، ایمونوتراپی است که در درمان انواع خاصی از سرطان، به ویژه سرطان های خون مانند لوسمی و لنفوم استفاده می شود. این درمان شامل اصلاح سلول های Tبیمار برای بیان یک گیرنده آنتی ژن کایمریک (CAR) بر روی سطح آنها است. این گیرنده برای شناسایی آنتی ژن های خاص موجود در سطح سلول های سرطانی طراحی شده است و سلول های T اصلاح شده را قادر می سازد تا سلول های سرطانی را هدف قرار داده و از بین ببرند.
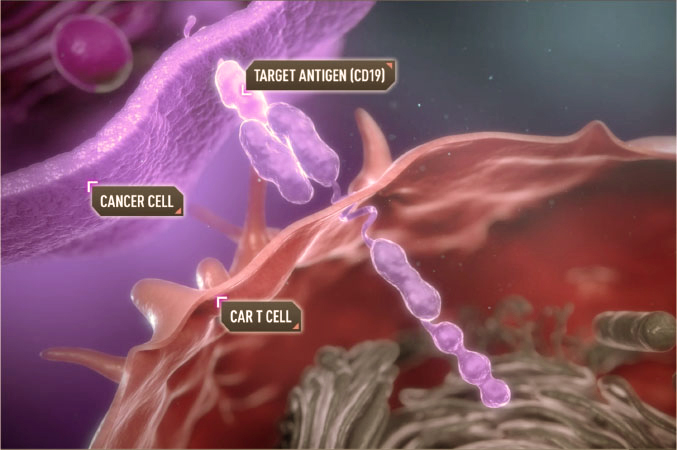
نمونه هایی از CAR-T Cell Therapy
Kymriah (Tisagenlecleucel ): این دارو، یکی از اولین درمان های مبتنی بر CAR-T cell بوده که توسط FDA تأیید شده است. این دارو برای درمان کودکان و بیماران بالغ جوان مبتلا به لوسمی لنفوبلاستیک حاد سلول B (ALL) که به درمان های دیگر پاسخ نداده اند و یا بیماری آنها عود کرده است، استفاده می شود.
Yescarta (Axicabtagene Ciloleucel) : این دارو برای درمان بیماران مبتلا به لنفوم سلول B بزرگ عودکننده یا مقاوم به درمان و لنفوم سلول B بزرگ مدیاستن اولیه استفاده می شود.
مزایای CAR- T CELL THERAPY
درمان هدفمند: CAR- T CELL THERAPY یک رویکرد بسیار هدفمند برای درمان سرطان ارائه می دهد. گیرنده های CAR به گونه ای مهندسی می شوند که به طور خاص سلول های سرطانی را تشخیص دهند، آسیب به سلول های سالم را کاهش دهند و عوارض جانبی مرتبط با درمان های سنتی را به حداقل برسانند.
اثرات طولانی مدت: سلول های CAR-T می توانند پس از درمان در بدن باقی بمانند و برای مدت طولانی به هدف قرار دادن سلول های سرطانی ادامه دهند و به طور بالقوه پاسخی طولانی مدت را در بدن ایجاد کنند.
معایب CAR- T CELL THERAPY
سندرم آزادسازی سیتوکین (CRS): یکی از عوارض جانبی مهم این روش، سندرم آزادسازی سیتوکین است، یک واکنش ایمنی شدید که می تواند منجر به تب، علائم شبیه آنفولانزا و حتی اختلال در عملکرد اعضا شود. این عارضه، زمانی رخ میدهد که cell CAR-T های فعال شده، مقادیر زیادی سیتوکین (مولکولهای سیگنالدهنده) را در جریان خون آزاد میکنند.
مسمومیت عصبی: برخی از بیماران ممکن است عوارض جانبی عصبی از جمله گیجی، تشنج و هذیان را تجربه کنند.
کاربرد محدود: CAR-T Cell Therapy در حال حاضر برای انواع خاصی از سرطان خون تایید شده است. کاربرد آن در تومورهای جامد به دلیل مسائلی مانند ناهمگونی تومور و مشکلات در هدف قرار دادن آنتی ژن های خاص تومورهای جامد محدود است.
درمان با لنفوسیت های نفوذ کننده تومور
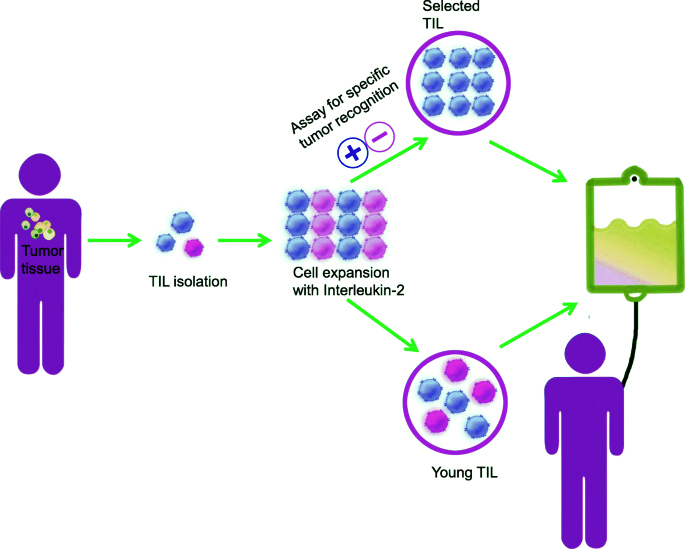
درمان با لنفوسیت های نفوذ کننده تومور (TIL) یک رویکرد ایمونوتراپی است که در درمان انواع خاصی از سرطان، به ویژه تومورهای جامد استفاده می شود.
درمان TIL شامل استخراج لنفوسیت های T سیستم ایمنی از تومور بیمار و انتخاب و گسترش سلولهایی است که به طور خاص سرطان را هدف قرار میدهند.
نمونه هایی از درمان لنفوسیتی نفوذ کننده تومور عبارتند از:
درمان ملانوما: درمان TIL به طور گسترده در زمینه ملانوم پیشرفته، مورد مطالعه قرار گرفته است. برخی از آزمایشهای بالینی نتایج امیدوارکنندهای را نشان دادهاند که منجر به پاسخهای بادوام در گروهی از بیماران شده است.
درمان سرطان دهانه رحم: درمان TIL در سرطان دهانه رحم نیز مورد بررسی قرار گرفته است. تعداد کمی از بیماران مبتلا به سرطان دهانه رحم پیشرفته به درمان TIL پاسخ نشان داده اند.
مزایای درمان با لنفوسیت های نفوذ کننده تومور عبارتست از:
درمان شخصی: درمان TIL برای هر بیمار شخصی سازی شده است. لنفوسیت های استخراج شده مختص تومور بیمار هستند و به طور بالقوه اثربخشی درمان را افزایش می دهند.
نفوذ طبیعی: TIL ها از خود تومور مشتق می شوند، که نشان دهنده توانایی این لنفوسیت ها برای نفوذ به محیط تومور است.
درمان پایدار: برخی از بیماران تحت درمان با TIL، پاسخهای طولانیمدتی را تجربه کردهاند که نشان دهنده پتانسیل این درمان برای ارائه اثرات ضد سرطانی پایدار است.
معایب درمان با لنفوسیت های نفوذ کننده تومور:
کاربرد محدود: درمان TIL در انواع خاصی از سرطانها، مانند ملانوما، که در آن TILها فراوانتر هستند، موفق تر بوده است. اثربخشی این درمان در سایر تومورهای جامد ممکن است به دلیل مسائلی مانند نفوذ ناکافی TIL محدودتر باشد.
پیچیدگی و تنوع: درمان TIL شامل مراحل متعددی از جمله استخراج، تکثیر و تزریق مجدد است. تنوع در کیفیت و کمیت TIL های به دست آمده از هر بیمار می تواند بر نتایج درمان تأثیر بگذارد.
عوارض جانبی مرتبط با سیستم ایمنی: مانند سایر درمانهای مبتنی بر ایمنی، درمان TIL میتواند منجر به عوارض جانبی مرتبط با ایمنی، از جمله سندرم آزادسازی سیتوکین و ایجاد بیماری های اتوایمیون شود.
عدم اختصاصیت: در حالی که TIL ها ممکن است به تومور نفوذ کرده باشند، منحصراً سلول های سرطانی را هدف قرار نمی دهند. این عدم اختصاصیت می تواند منجر به آسیب به بافت های سالم نیز شود.
ناهمگنی تومور: تومورهای جامد اغلب ساختار ناهمگنی را نشان می دهند، به این معنی که مناطق مختلف تومور ممکن است ویژگی های متمایزی داشته باشند. TIL های به دست آمده از یک قسمت از تومور ممکن است بر قسمت های دیگر تومور موثر نباشند.
درمان با سلول های گیرنده آنتی ژن کایمریک، ایمونوتراپی است که در درمان انواع خاصی از سرطان، به ویژه سرطان های خون مانند لوسمی و لنفوم استفاده می شود. این درمان شامل اصلاح سلول های Tبیمار برای بیان یک گیرنده آنتی ژن کایمریک (CAR) بر روی سطح آنها است. این گیرنده برای شناسایی آنتی ژن های خاص موجود در سطح سلول های سرطانی طراحی شده است و سلول های T اصلاح شده را قادر می سازد تا سلول های سرطانی را هدف قرار داده و از بین ببرند.

نمونه هایی از CAR-T Cell Therapy
Kymriah (Tisagenlecleucel ): این دارو، یکی از اولین درمان های مبتنی بر CAR-T cell بوده که توسط FDA تأیید شده است. این دارو برای درمان کودکان و بیماران بالغ جوان مبتلا به لوسمی لنفوبلاستیک حاد سلول B (ALL) که به درمان های دیگر پاسخ نداده اند و یا بیماری آنها عود کرده است، استفاده می شود.

Yescarta (Axicabtagene Ciloleucel) : این دارو برای درمان بیماران مبتلا به لنفوم سلول B بزرگ عودکننده یا مقاوم به درمان و لنفوم سلول B بزرگ مدیاستن اولیه استفاده می شود.
مزایای CAR- T CELL THERAPY
درمان هدفمند: CAR- T CELL THERAPY یک رویکرد بسیار هدفمند برای درمان سرطان ارائه می دهد. گیرنده های CAR به گونه ای مهندسی می شوند که به طور خاص سلول های سرطانی را تشخیص دهند، آسیب به سلول های سالم را کاهش دهند و عوارض جانبی مرتبط با درمان های سنتی را به حداقل برسانند.
اثرات طولانی مدت: سلول های CAR-T می توانند پس از درمان در بدن باقی بمانند و برای مدت طولانی به هدف قرار دادن سلول های سرطانی ادامه دهند و به طور بالقوه پاسخی طولانی مدت را در بدن ایجاد کنند.
معایب CAR- T CELL THERAPY
سندرم آزادسازی سیتوکین (CRS): یکی از عوارض جانبی مهم این روش، سندرم آزادسازی سیتوکین است، یک واکنش ایمنی شدید که می تواند منجر به تب، علائم شبیه آنفولانزا و حتی اختلال در عملکرد اعضا شود. این عارضه، زمانی رخ میدهد که cell CAR-T های فعال شده، مقادیر زیادی سیتوکین (مولکولهای سیگنالدهنده) را در جریان خون آزاد میکنند.
مسمومیت عصبی: برخی از بیماران ممکن است عوارض جانبی عصبی از جمله گیجی، تشنج و هذیان را تجربه کنند.
کاربرد محدود: CAR-T Cell Therapy در حال حاضر برای انواع خاصی از سرطان خون تایید شده است. کاربرد آن در تومورهای جامد به دلیل مسائلی مانند ناهمگونی تومور و مشکلات در هدف قرار دادن آنتی ژن های خاص تومورهای جامد محدود است.
درمان با لنفوسیت های نفوذ کننده تومور Tumor-Infiltrating lymphocyte Therapy
درمان با لنفوسیت های نفوذ کننده تومور (TIL) یک رویکرد ایمونوتراپی است که در درمان انواع خاصی از سرطان، به ویژه تومورهای جامد استفاده می شود.
درمان TIL شامل استخراج لنفوسیت های T سیستم ایمنی از تومور بیمار و انتخاب و گسترش سلولهایی است که به طور خاص سرطان را هدف قرار میدهند.

نمونه هایی از درمان لنفوسیتی نفوذ کننده تومور عبارتند از:
درمان ملانوما: درمان TIL به طور گسترده در زمینه ملانوم پیشرفته، مورد مطالعه قرار گرفته است. برخی از آزمایشهای بالینی نتایج امیدوارکنندهای را نشان دادهاند که منجر به پاسخهای بادوام در گروهی از بیماران شده است.
درمان سرطان دهانه رحم: درمان TIL در سرطان دهانه رحم نیز مورد بررسی قرار گرفته است. تعداد کمی از بیماران مبتلا به سرطان دهانه رحم پیشرفته به درمان TIL پاسخ نشان داده اند.
مزایای درمان با لنفوسیت های نفوذ کننده تومور عبارتست از:
درمان شخصی: درمان TIL برای هر بیمار شخصی سازی شده است. لنفوسیت های استخراج شده مختص تومور بیمار هستند و به طور بالقوه اثربخشی درمان را افزایش می دهند.
نفوذ طبیعی: TIL ها از خود تومور مشتق می شوند، که نشان دهنده توانایی این لنفوسیت ها برای نفوذ به محیط تومور است.
درمان پایدار: برخی از بیماران تحت درمان با TIL، پاسخهای طولانیمدتی را تجربه کردهاند که نشان دهنده پتانسیل این درمان برای ارائه اثرات ضد سرطانی پایدار است.
معایب درمان با لنفوسیت های نفوذ کننده تومور:
کاربرد محدود: درمان TIL در انواع خاصی از سرطانها، مانند ملانوما، که در آن TILها فراوانتر هستند، موفق تر بوده است. اثربخشی این درمان در سایر تومورهای جامد ممکن است به دلیل مسائلی مانند نفوذ ناکافی TIL محدودتر باشد.
پیچیدگی و تنوع: درمان TIL شامل مراحل متعددی از جمله استخراج، تکثیر و تزریق مجدد است. تنوع در کیفیت و کمیت TIL های به دست آمده از هر بیمار می تواند بر نتایج درمان تأثیر بگذارد.
عوارض جانبی مرتبط با سیستم ایمنی: مانند سایر درمانهای مبتنی بر ایمنی، درمان TIL میتواند منجر به عوارض جانبی مرتبط با ایمنی، از جمله سندرم آزادسازی سیتوکین و ایجاد بیماری های اتوایمیون شود.
عدم اختصاصیت: در حالی که TIL ها ممکن است به تومور نفوذ کرده باشند، منحصراً سلول های سرطانی را هدف قرار نمی دهند. این عدم اختصاصیت می تواند منجر به آسیب به بافت های سالم نیز شود.
ناهمگنی تومور: تومورهای جامد اغلب ساختار ناهمگنی را نشان می دهند، به این معنی که مناطق مختلف تومور ممکن است ویژگی های متمایزی داشته باشند. TIL های به دست آمده از یک قسمت از تومور ممکن است بر قسمت های دیگر تومور موثر نباشند.
واکسن های سرطان (Cancer Vaccines)
واکسن های سرطان نوعی ایمونوتراپی هستند که هدف آن تحریک سیستم ایمنی بدن بیمار برای شناسایی و هدف قرار دادن موثرتر سلول های سرطانی است. واکسنهای سرطان از سلولهای سرطانی مرده، پروتئینها یا قطعات سلولهای سرطانی یا سلولهای سیستم ایمنی ساخته میشوند این واکسن ها با تزریق به بدن بیمار، آنتی ژن های تومور را به سیستم ایمنی معرفی می کند و از این طریق سلول های سیستم ایمنی این آنتی ژن ها را شناسایی کرده و به خاطر می سپارند.
واکسن های سرطان را می توان به دو دسته اصلی تقسیم کرد:
واکسن های پیشگیری کننده سرطان: این واکسن ها برای جلوگیری از ایجاد سرطان در افرادی طراحی شده اند که به دلیل عواملی مانند سابقه خانوادگی یا استعداد ژنتیکی در معرض خطر بالای ابتلا به سرطان هستند. شناخته شده ترین نمونه از این دسته واکسن ها، شامل واکسن HPV (ویروس پاپیلومای انسانی) است که به پیشگیری از انواع خاصی از عفونت های HPV که می تواند منجر به سرطان دهانه رحم و سایر سرطان ها شود، کمک می کند.
واکسنهای درمانی سرطان: هدف این واکسنها درمان سرطان موجود با افزایش توانایی سیستم ایمنی برای شناسایی و حمله به سلولهای سرطانی است. واکسن های درمانی سرطان را می توان شخصی سازی کرد به نحوی که آنتی ژن های خاص موجود در سلول های سرطانی بیمار را هدف قرار دهند.
مزایای واکسن های سرطان:
رویکرد هدفمند: واکسن های سرطان را می توان برای هدف قرار دادن آنتی ژن های خاص موجود بر روی سلول های سرطانی طراحی کرد و خطر آسیب رساندن به سلول های سالم را کاهش داد.
پاسخ ایمنی طولانی مدت: یک واکسن موفق می تواند منجر به توسعه سلول های ایمنی خاطره شود، به این معنی که سیستم ایمنی می تواند حتی پس از درمان اولیه به هدف قرار دادن سلول های سرطانی ادامه دهد.
کاهش عوارض جانبی: در مقایسه با درمانهای سنتی مانند شیمیدرمانی، واکسنهای سرطان ممکن است عوارض جانبی سیستمیک کمتری داشته باشند زیرا فقط برای هدف قرار دادن سلولهای سرطانی طراحی شدهاند.
معایب واکسن های سرطان:
اثربخشی محدود: سلولهای سرطانی اغلب مکانیسمهایی برای فرار از سیستم ایمنی ایجاد میکنند که میتواند اثربخشی واکسنها را محدود کند.
تغییرپذیری بیمار: موفقیت واکسن سرطان می تواند در بین بیماران به دلیل تفاوت در پاسخ ایمنی و ویژگی های خاص سرطان آنها متفاوت باشد.
هزینه زیاد: توسعه و آزمایش واکسنهای سرطان فرآیندی زمانبر و پرهزینه است.
سیتوکین تراپی (Cytokine Therapy)
سیتوکین تراپی نوعی ایمونوتراپی است که شامل استفاده از مولکول های سیگنالینگ خاص به نام سیتوکین ها برای تحریک پاسخ سیستم ایمنی فرد در برابر سلول های سرطانی است. سیتوکین ها پروتئین هایی هستند که پاسخ های ایمنی، رشد سلولی و التهاب را تنظیم می کنند. دو نوع عمده سیتوکین مورد استفاده در درمان سرطان اینترلوکین ها و اینترفرون ها هستند.
اینترلوکین ها سیتوکین هایی هستند که به تنظیم پاسخ های ایمنی کمک می کنند. IL-2 و IL-12 معمولاً در درمان سرطان استفاده می شوند.
- IL-2 رشد و فعال شدن سلول های ایمنی مختلف از جمله سلول های T و سلول های کشنده طبیعی (NK) را تحریک می کند. Aldesleukin با دوز بالا برای درمان ملانوم پیشرفته و کارسینوم سلول کلیه استفاده می شود.
- IL-12 با افزایش تولید اینترفرون گاما، فعالیت ضد تومور را توسط سیستم ایمنی افزایش می دهد.
- درمان با اینترفرون: اینترفرون ها پروتئین هایی هستند که با تکثیر ویروسی تداخل دارند و پاسخ های ایمنی را تعدیل می کنند. اینترفرون آلفا در درمان سرطان برای تحریک سلول های ایمنی و مهار رشد سلول های سرطانی برای درمان انواع خاصی از لوسمی، لنفوم و ملانوم استفاده می شود.
مزایای استفاده از سیتوکین ها
تحریک پاسخ ایمنی: سیتوکین ها می توانند فعالیت سلول های ایمنی را افزایش دهند و منجر به پاسخ ایمنی قوی تر در برابر سلول های سرطانی شوند.
پاسخ های طولانی مدت: در برخی موارد، سیتوکین های درمانی می تواند به پاسخ های با دوام و بهبودی طولانی مدت منجر شود.
کاربرد گسترده: سیتوکین درمانی به طور بالقوه می تواند برای انواع مختلفی از سرطان استفاده شود زیرا به جای حمله مستقیم به سلول های سرطانی خاص، پاسخ سیستم ایمنی را هدف قرار می دهد. این تطبیق پذیری به ویژه برای سرطان هایی که ممکن است به درمان های سنتی به خوبی پاسخ ندهند بسیار ارزشمند است.
اثر سیستمیک: سیتوکین درمانی می تواند تومورهای اولیه و متاستاتیک را در سراسر بدن هدف قرار دهد. این اثر سیستمیک به ویژه هنگام برخورد با سرطان هایی که به چندین محل گسترش یافته اند سودمند است.
معایب استفاده از سیتوکین ها
سمیت بالا : استفاده از سیتوکین های درمانی با دوز بالا منجر به عوارض جانبی شدید از جمله تب، لرز، خستگی، دردهای عضلانی تعداد کم سلول های خونی و سمیت اندام شود.
سندرم نشت مویرگی: دوزهای بالای سیتوکین ، مانند اینترلوکین-2 ، می تواند منجر به وضعیتی به نام سندرم نشت مویرگی شود. این وضعیت باعث نفوذپذیری عروق خونی شده و منجر به نشت مایع به بافت ها و اندام ها می شود که منجر به ادم، فشار خون پایین و اختلال عملکرد اندام ها می شود.
سمیت خونی: سیتوکین درمانی می تواند عملکرد مغز استخوان را سرکوب کند و منجر به کاهش تولید سلول های خونی از جمله گلبول های قرمز، گلبول های سفید و پلاکت ها شود.
واکنش های خود ایمنی: فعال شدن سیستم ایمنی که توسط سیتوکین ها ایجاد می شود گاهی اوقات می تواند منجر به واکنش های خود ایمنی شود که در آن سیستم ایمنی علاوه بر سلول های سرطانی به بافت های طبیعی نیز حمله می کند.
مقاومت: برخی از سرطان ها ممکن است به مرور زمان نسبت به سیتوکین های درمانی مقاوم شوند.
مدت زمان ایمونوتراپی
دوره درمان ایمونوتراپی در سرطان می تواند تحت تأثیر عوامل متعددی باشد، از جمله :
- نوع سرطان
- نوع ایمونوتراپی
- پاسخ فردی بیمار به درمان
- مرحله بیماری
براساس این عوامل، ایمونوتراپی می تواند از رژیم های درمانی کوتاه مدت تا طولانی مدت را شامل شود.
درمان کوتاه مدت (هفته تا ماه)
برخی از بیماران ممکن است یک دوره کوتاه ایمونوتراپی دریافت کنند که معمولاً چند هفته تا چند ماه طول می کشد. این رویکرد برای انواع خاصی از سرطان رایج است، به ویژه هنگامی که با درمان های دیگر مانند شیمی درمانی یا پرتودرمانی ادغام شود. ایمونوتراپی کوتاه مدت ممکن است برای تقویت سریع پاسخ ایمنی، القای کوچک شدن تومور، یا آماده کردن ریزمحیط تومور برای درمان های دیگر استفاده شود.
درمان میان مدت (چند ماه تا یک سال)
بسیاری از بیماران تحت یک رژیم ایمونوتراپی میان مدت قرار می گیرند که به طور معمول از چند ماه تا یک سال طول می کشد. این مدت به سیستم ایمنی زمان کافی برای پاسخ به درمان می دهد که منجر به کوچک شدن و تثبیت بالقوه تومور می شود.
درمان طولانی مدت
برخی از بیماران مبتلا به سرطان های پیشرفته یا متاستاتیک ممکن است به دریافت ایمونوتراپی به صورت مداوم به عنوان یک درمان نگهدارنده ادامه دهند. هدف درمان طولانی مدت کنترل بیماری، جلوگیری از رشد بیشتر تومور و حفظ کیفیت زندگی بیمار است.
درمان کمکی (بعد از جراحی یا سایر درمانها)
در برخی موارد، ایمونوتراپی به عنوان درمان کمکی پس از جراحی یا سایر درمان های اولیه برای کاهش خطر عود سرطان استفاده می شود. درمان کمکی میتواند در یک دوره مشخص ادامه یابد تا اطمینان حاصل شود که سلولهای سرطانی باقیمانده هدف قرار میگیرند. توجه به این نکته ضروری است که ایمونوتراپی همیشه از یک جدول زمانی دقیق پیروی نمی کند، زیرا پاسخ هر بیمار به درمان منحصر به فرد است. برخی از بیماران ممکن است پاسخ های سریعی را به درمان بدهند، در حالی که برخی دیگر ممکن است به زمان بیشتری نیاز داشته باشند. در مواردی که درمان موثر باشد، پزشکان ممکن است ایمونوتراپی را تا زمانی که شواهدی از پیشرفت بیماری وجود داشته باشد، ادامه دهند.
مزایا و معایب ایمونوتراپی
ایمونوتراپی با استفاده از سیستم ایمنی بدن برای هدف قرار دادن سلول های سرطانی انقلابی در درمان سرطان ایجاد کرده است. با این حال، مانند تمام مداخلات پزشکی، ایمونوتراپی نیز می تواند منجر به عوارض جانبی شود. عوارض جانبی خاص بر اساس نوع ایمونوتراپی، پاسخ فردی بیمار و نوع سرطان تحت درمان متفاوت است. در اینجا برخی از عوارض جانبی رایج مرتبط با ایمونوتراپی آورده شده است:
عوارض جانبی مرتبط با سیستم ایمنی
در ایمونوتراپی، سیستم ایمنی علاوه بر سلول های سرطانی به بافت های سالم نیز حمله می کند. عوارض جانبی مرتبط با این موضوع عبارتند از: بثورات پوستی، اسهال، کولیت، هپاتیت، اختلال عملکرد تیروئید و پنومونیت.
واکنش های پوستی
عوارض جانبی مرتبط با پوست می تواند شامل بثورات، خارش و تاول باشد. برخی از بیماران ممکن است به دلیل پاسخ ایمنی دچار شرایط پوستی خاصی مانند درماتیت یا ویتیلیگو شوند.
مشکلات گوارشی
اسهال، تهوع، استفراغ و درد شکم از عوارض جانبی احتمالی هستند. موارد شدید می تواند منجر به کولیت شود.
اختلال عملکرد غدد درون ریز
برخی از ایمونوتراپی ها می توانند بر سیستم غدد درون ریز تأثیر بگذارند و منجر به عدم تعادل هورمونی و شرایطی مانند اختلال عملکرد تیروئید یا نارسایی غدد فوق کلیوی شوند.
پنومونیت
در برخی موارد، در اثر ایمونوتراپی، التهاب ریه ها (پنومونیت) رخ می دهد و علائمی مانند تنگی نفس، سرفه یا درد قفسه سینه ایجاد می شود.
علائم شبیه آنفولانزا
برخی از بیماران ممکن است علائمی شبیه آنفولانزا از جمله تب، لرز، دردهای عضلانی و سردرد را تجربه کنند. این علائم اغلب با پاسخ ایمنی مرتبط است.توجه به این نکته ضروری است که اگرچه عوارض جانبی ایمونوتراپی می تواند چالش برانگیز باشد، اما معمولاً با تشخیص زودهنگام و مداخله مناسب قابل کنترل هستند.
نتیجه گیری
پتانسیل ایمونوتراپی برای ترکیب با سایر درمانها، گزینههای درمانی را برای بیماران در انواع مختلف سرطان، از جمله کسانی که جایگزینهای درمانی محدودی دارند، گسترش داده است. با این حال، مانند هر مداخله پزشکی، ایمونوتراپی نیز با چالش هایی روبه رو است. پاسخهای بیمار میتواند بسیار متفاوت باشد و عوارض جانبی مرتبط با ایمنی نیاز به نظارت و مدیریت دقیق دارد. پیگیری مداوم، اصلاح پروتکلهای درمانی، انتخاب درست بیمار و کشف پیچیدگیهای تعاملات سیستم ایمنی با سلولهای سرطانی همچنان هدف اصلی تحقیقات است.
